Baie van ons pasiënte weet reeds van die toenemende behoefte aan nuwe antifungale middels; behandelings vir swamsiektes soos aspergillose het aansienlike beperkings. Toksisiteite, geneesmiddel-middel-interaksies, weerstand en dosering is almal kwessies wat terapie kan bemoeilik; daarom, hoe meer behandelingsopsies ons het, hoe groter is die kans dat ons 'n optimale terapeutiese opsie vir pasiënte sal vind.
Die ontwikkeling van antifungale middels is moeilik weens die biologiese ooreenkomste tussen mense en swamme; ons deel baie van dieselfde biologiese weë as swamme, wat probleme skep met die ontwikkeling van veilige antifungale middels. Om nuwe antifungale middels te ontwikkel, moet navorsers kyk hoe hulle sommige van die verskille wat ons het, kan ontgin.
Hieronder is 'n leek se uiteensetting van 'n onlangs gepubliseerde resensie wat gekyk het na sewe antifungale middels wat tans in verskillende stadiums van ontwikkeling is. Die meerderheid nuwe antifungale middels was nuwe weergawes van ou medisyne, maar dié wat in hierdie oorsig bespreek word, het nuwe werkingsmeganismes en verskillende doseringsregimes, so, indien dit goedgekeur word, kan hierdie middels 'n straal van hoop in die nie so verre toekoms verskaf. terme van behandeling.
Rezafungin

Rezafungin is tans in fase 3 van ontwikkeling. Dit is 'n lid van die echinokandienklas medisyne, insluitend micafungien en caspofungien; Echinokandine werk deur 'n swamselwandkomponent wat noodsaaklik is vir homeostase te inhibeer.
Rezafungin is ontwikkel om die veiligheidsvoordele van sy echinocandin-voorgangers te behou; terwyl die farmakokinetiese en farmakodinamiese eienskappe daarvan verbeter word om 'n unieke, langerwerkende, meer stabiele behandeling te skep wat weeklikse intraveneuse eerder as daaglikse toediening moontlik maak, wat die behandelingsopsies moontlik uitbrei in die omgewing van echinokandienweerstand.
Fosmanogepix
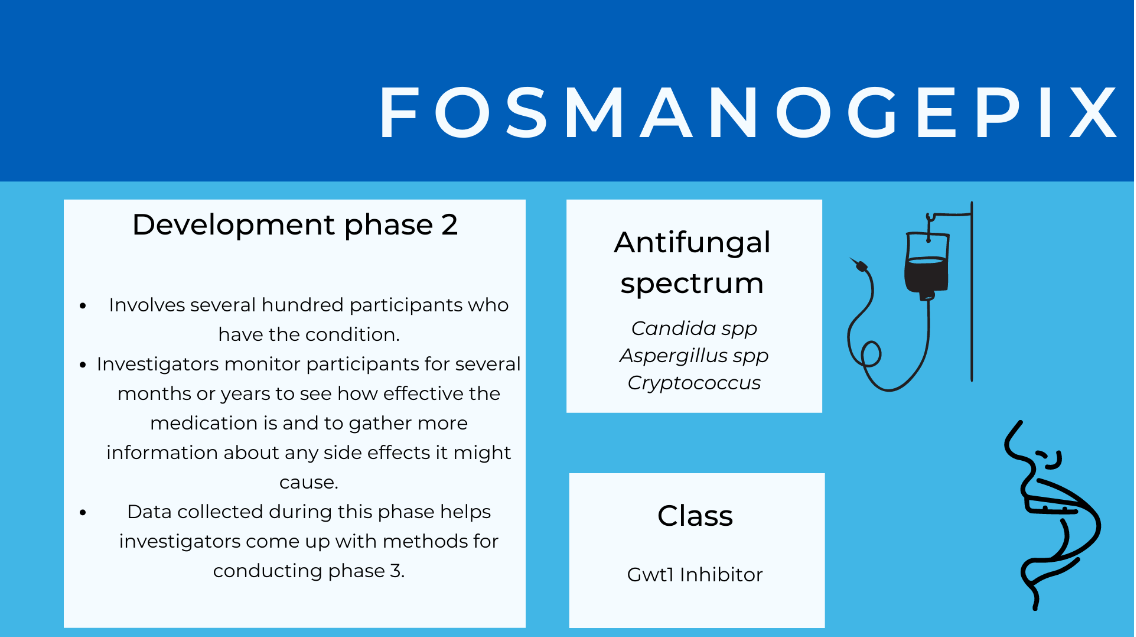
Fosmanogepix is bekend as 'n eerste-in-klas middel (dus eerste van sy soort antifungale middel) wat die produksie van 'n noodsaaklike verbinding blokkeer wat belangrik is vir die konstruksie van die selwand en selfregulering. Om die produksie van hierdie verbinding te blokkeer, verswak die sel se wand genoeg dat die sel nie meer ander selle kan besmet of die immuunstelsel kan ontduik nie. Dit is tans in Fase 2 kliniese proewe en toon belowende resultate in die orale en binneaarse behandeling van veelvuldige indringende swaminfeksies, wat doeltreffendheid in multi-middel weerstandbiedende en ander moeilik behandelbare infeksies toon.
Olorifim
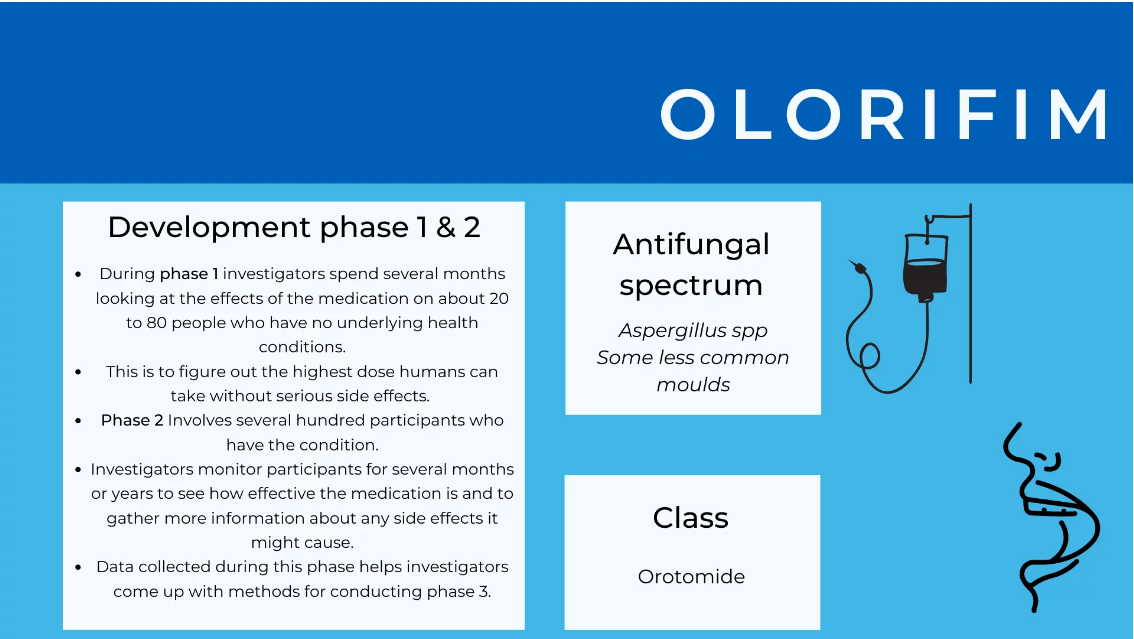
Olorifim val onder 'n heeltemal nuwe klas antifungale middels genaamd orotomides. Die orotomiede het 'n duidelike werkingsmeganisme, wat selektief 'n sleutelensiem in pirimidienbiosintese teiken. Pirimidien is 'n noodsaaklike molekule in DNA, RNA, selwand- en fosfolipiedsintese, selregulering en proteïenproduksie, so wanneer Olorofim hierdie ensiem teiken, beïnvloed dit die swamme diep. Ongelukkig is Olorifim nie 'n breë spektrum nie, en dit maak net 'n paar swamme dood – pertinent, Aspergillus, en die swam wat valleikoors veroorsaak (wat die brein affekteer), Coccidioides. Sedert sy ontdekking het dit gevorder deur pre-kliniese studies en fase 1 menslike proewe en is tans 'n deurlopende fase 2 kliniese proef wat die gebruik daarvan mondelings en binneaars toets.
Ibrexafungerp
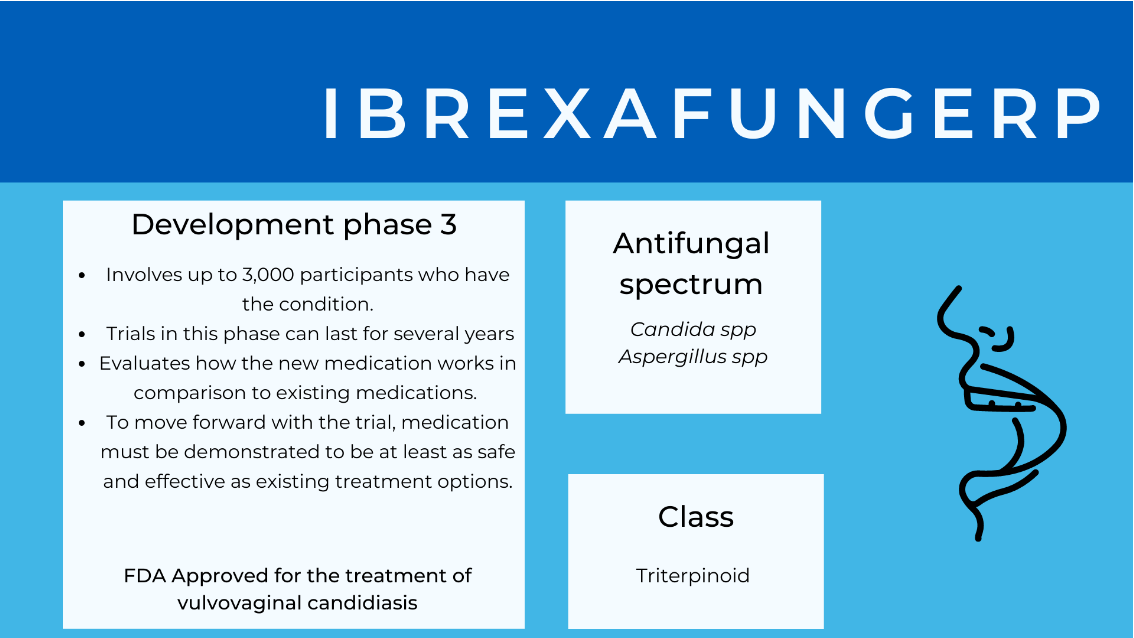
Ibrexafungerp is die eerste van 'n nuwe klas antifungale middels genaamd Triterpenoids. Ibrexafungerp teiken dieselfde noodsaaklike komponent van die swam selwand wat die echinocandins doen, maar dit het 'n heeltemal ander struktuur, wat dit stabieler maak en beteken dat dit oraal gegee kan word; Ibrexafungerp te onderskei van die drie huidig beskikbare echinokandiene (caspofungien, micafungien, andulafungien), wat slegs binneaars toegedien kan word wat die gebruik daarvan beperk tot gehospitaliseerde pasiënte en diegene met inwonende veneuse toegang.
Daar is twee voortdurende fase 3 proewe van ibrexafungerp. Die mees uitgebreide inskrywingstudie tot nog toe is die FURI-studie, wat die doeltreffendheid en veiligheid van Ibrexafungerp evalueer onder pasiënte met ernstige swaminfeksie en wat nie reageer of onverdraagsaam is teenoor standaard antifungale middels nie. Die mondelinge formulering is onlangs deur die VSA se Food and Drug Administration (FDA) goedgekeur vir die behandeling van vulvovaginale candidiasis (VVC).
Otesekonasool

Otesekonasool is die eerste van verskeie tetrasoolmiddels wat ontwerp is met die doel van groter selektiwiteit, minder newe-effekte en verbeterde doeltreffendheid in vergelyking met tans beskikbare asole. Otesekonasool is ontwerp om styf te bind aan 'n ensiem genaamd sitochroom P450. Toe ons vroeër bespreek het dat swamme en mense soortgelyk is, is sitochroom P450 een van daardie ooreenkomste. Menslike selle bevat verskeie spesies sitochroom P450, wat verantwoordelik is vir baie belangrike metaboliese funksies. Daarom, as asool antifungale middels die menslike sitochroom P450 inhibeer, kan die gevolg nadelige reaksies wees. Maar, anders as ander asool antifungale middels, inhibeer Oteseconazole slegs die swam sitochroom p450 - nie die menslike een nie as gevolg van sy affiniteit vir die teiken ensiem (sitochroom P450) is groter. Dit behoort minder dwelm-middel-interaksies en minder direkte toksisiteit te beteken.
Otesekonasool is in fase 3 van ontwikkeling en is tans onder FDA-oorweging vir goedkeuring om herhalende vulvovaginale candidiasis te behandel.
Encochleated Amphotericin B

Baie van ons pasiënte sal reeds bewus wees van Amphotericin B, wat reeds sedert die 1950's bestaan. Amfoterisien B val onder die klas dwelms genoem Polyenes- die oudste klas van antifungale middels beskikbaar. Hulle maak swamme dood deur aan ergosterol te bind wat die selmembraanintegriteit handhaaf. Die middel werk deur die ergosterol te verwyder, wat gate in die selmembraan veroorsaak, wat dit lek genoeg maak om te misluk. Maar poliëene het ook interaksie met cholesterol in menslike selmembrane, wat beteken dat hulle aansienlike toksisiteite het. Encochleated Amphotericin B is ontwikkel om hierdie beduidende toksisiteite te vermy - die nuwe lipied-nanokristalontwerp maak voorsiening vir dwelmaflewering direk aan die besmette weefsels, wat die liggaam beskerm teen onnodige blootstelling - en dit kan mondelings gegee word, wat moontlik hospitaalverblyf verminder.
Encochleated Amphotericin B is tans in fase 1 en 2 van ontwikkeling, so 'n entjie weg. Tog beloof dit die potensiaal van 'n orale middel met min, indien enige, van die tipiese toksisiteite van amfoterisien B.
ATI-2307

ATI-2307 is in die baie vroeë stadiums van ontwikkeling en is 'n nuwe antifungale middel met 'n unieke werkingsmeganisme. ATI-2307 inhibeer mitochondriale funksie (mitochondria is strukture binne selle wat voedsel omskakel na energie), wat die produksie van ATP (adenosientrifosfaat) verminder, wat die molekule is wat energie dra, wat lei tot groei-inhibisie.
Soos vroeër genoem, is ATI-2307 nog in die vroeë stadiums. Tog het navorsers drie Fase 1 kliniese studies voltooi wat getoon het dat dit goed verdra word in mense teen verwagte terapeutiese dosisvlakke. Dus, die kliniese rol vir ATI-2307 is onduidelik; die breë in vitro-aktiwiteit daarvan teen 'n gasheer van belangrike swampatogene, insluitend multi-middel-weerstandige organismes, kan egter 'n kritieke rol vir hierdie verbinding speel, veral vir swaminfeksies as gevolg van dwelm-weerstandige organismes soos asool-weerstandige Aspergillus spesies.